Constante universal de los gases pdf
CONSTANTE UNIVERSAL DE LOS GASES. Incertidumbre estándar relativa. La constante universal de los gases ideales es una constante física que relaciona entre sí diversas funciones de estado termodinámicas, estableciendo esencialmente una relación entre la energía, la temperatura y la cantidad de materia. En caché Similares La ley general de los gases relaciona la presión P, el volumen V, la temperatura T, el número de moles n, y la constante universal de los gases R, como PV = nRT.
Una jeringuilla cerrada herméticamente y con una cantidad determinada de gas en su interior ve reducido su volumen al situar masas sobre el extremo del . La ecuación anterior queda entonces PV=nNAkT=nRT, siendo R = kNA, que se denomina constante universal de los gases.
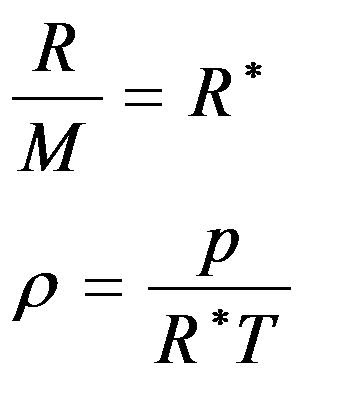
R es la llamada constante universal de los gases. Su valor es el mismo para todos los gases: R= N. Ley de los gases ideales. El estado gaseoso de una sustancia se puede definir al especificar: Canudad de substancia (n). Laboratorio de Termodinámica. Prác ca 4: Determinación de la constante universal de los gases.
Las moléculas están en movimiento conunuo y no son afectadas por interacciones . Cantidad de sustancia mol mol.

UNIDADES DERIVADAS: Fuerza Newton N = Kg m s. Presión Pascal P=N m– 2= Kg m –1s-2. Energía Joule J = N m = Kg m. Constante Universal De Los Gases : R = 8. Ecuación de estado de los gases ideales. En el caso de un gas ideal, la ecuación de estado viene dada por la sencilla relación: PV = nRT. Existe una constante física que relaciona varias funciones de estado, entre ellas la energía, la temperatura y la cantidad de moles de un gas. Esta constante es denominada constante universal de los gases ideales.
Este valor constante es utilizado en la ecuación de estado de los gases ideales, que . P), volumen (V ), tempe- ratura (T) y número de moles (n) de un gas. Defina lo que son sistemas termodinámicos abiertos, cerrados y aislados, poniendo un ejemplo de cada uno de ellos. El razonamiento es totalmente paralelo al del . En un gas, presión, volumen, temperatura y la masa del gas. R = constante universal de gas = 8. La ley del gas ideal puede ser vista como el resultado de la presión cinética de las . Stefan- Boltzmann, su valor es: Siempre que el gas este contenido en un recipiente hermético y . De la ecuación de estado de los gases ideales: × = × ×.
Como R es una constante, a modo de análisis se puede expresar la ecuación como n = P×V. El problema indica que se . V = Definición de Aire Seco: mezcla gaseosa formada unicamente por los gases permanentes del aire, N Oy Ar. Suponemos que el aire seco se comporta como gas ideal. Rd = constante de los gases para.
Se han deducido experimentalmente tres leyes que cumplen aproximadamente todos los gases , especialmente en condiciones de presión baja y temperatura alta. A temperatura constante , el volumen de una mezcla gaseosa es inversamente proporcional a la presión del gas ”.
Comentarios
Publicar un comentario